TP Pharmacologie
TP Pharmacologie
TP : Etude pharmacologique des récepteurs du muscle dorsal de sangsue
I. Introduction
Le but de ce TP est de caractériser le fonctionnement de la jonction neuromusculaire du
muscle dorsal de sangsue. Pour cela, l’étude repose sur des mesures de contraction induites
par divers agents connus pour agir directement sur cette synapse.
Les sangsues sont des animaux parasites qui se nourrissent de sang. Leur nom scientifique est
Hirudo medicinalis. Elles sont utilisées dans la médecine (d’où leur nom), du fait de
l’utilisation des propriétés anticoagulantes et anti-inflammatoires de leur salive. Par exemple,
on trouve une crème appelée Hirucreme qui utilise ces composants. Elles peuvent aussi être
utilisées pour faciliter certaines greffes, ou pour favoriser la formation de capillaires sanguins.
Elles possèdent 2 ventouses, l’une antérieure (bouche) et l’autre postérieure. La ventouse
antérieure possède 3 mâchoires portant chacune 60 à 100 dents leur permettant ainsi de
creuser la peau des animaux pour en aspirer le sang.
Elles se déplacent par ondulations, et sont capables d’une contraction et d’une extension
importante. Nous allons prélever un lambeau musculaire sur la partie dorsale de l’animal qui
est très pigmentée, et possède une dépression longitudinale-médiane. Pour cela, nous avons
découpé la partie ventrale de l’animal, cette partie est peu pigmentée et possède 2 dépressions
longitudinales-latérales.
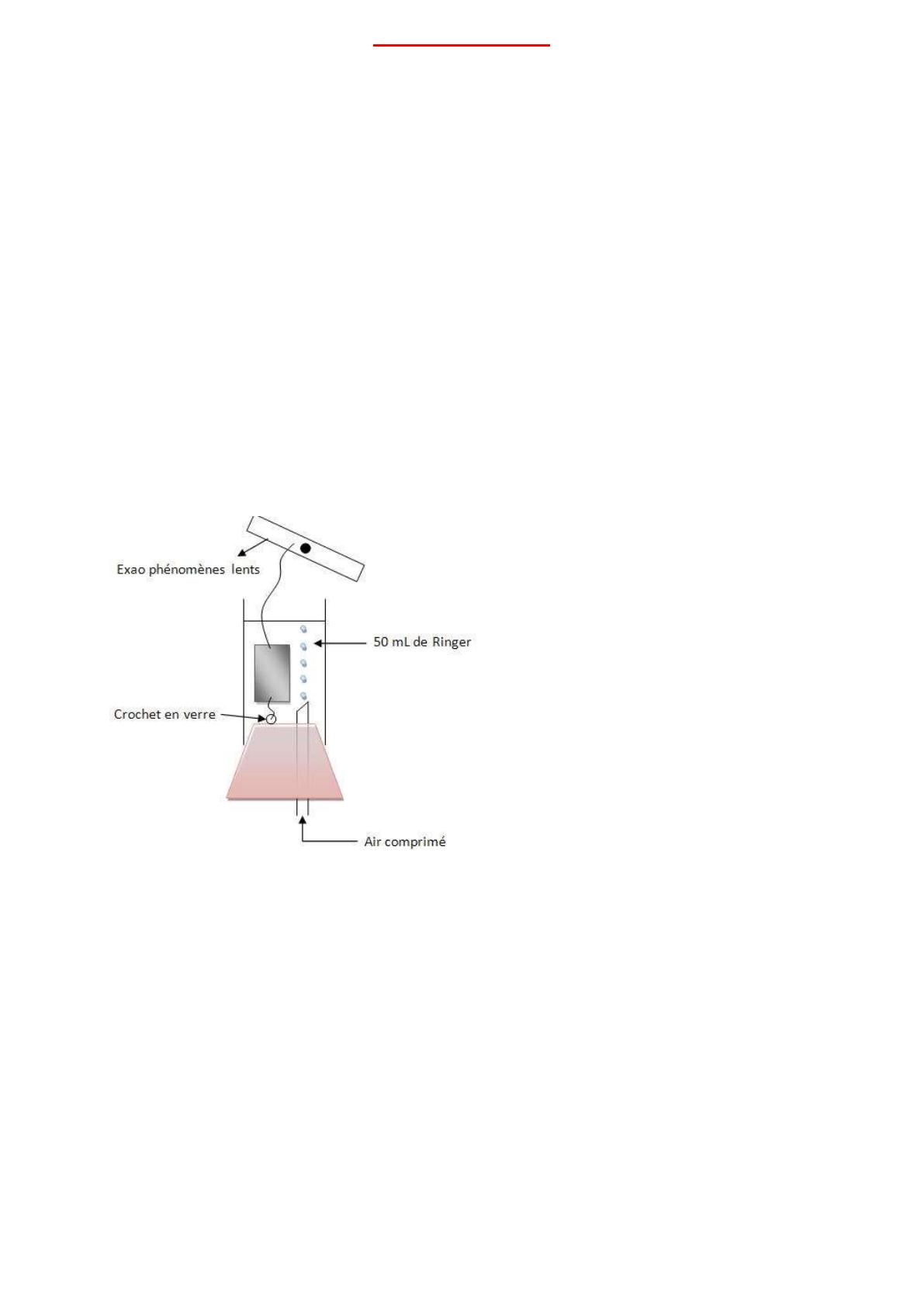
Nous avons ensuite installé notre lambeau musculaire dans une cuve à organes isolés, à l’aide
de deux fils à chaque extrémité.
II. Manipulation
A. Etude de l’effet de l’acétylcholine
On obtient une courbe, en injectant dans la préparation de l’acétylcholine, qui mesure la force
de contraction du muscle. Cette courbe est la courbe acétylcholine de l’annexe 1. Elle est de la
forme suivante :

On a injecté dans la cuve 10 µL d’une solution de chlorure d’acétylcholine à 10-1 M. La cuve
fait 50 mL. Or C1xV1 = C2xV2. Ici C1 = 0,1 M ; V1 = 1.10-5 L ; V2 = 5.10-2 L (50010 µL, on
ne considère que 50 mL, ce qui ne change quasiment rien aux calculs).
Donc C2 = C1xV1/V2 = 0,1x1.10-5/5.10-2 = 10-6/5.10-2 = 2.10-5 M
On remarque donc qu’après injection de l’acétylcholine, le muscle a une augmentation
d’activité, bien que celle-ci ne reste à un bas niveau. On peut donc conclure pour le moment
que l’acétylcholine permet dans le muscle dorsal de la sangsue d’effectuer des contractions. Il
existe donc dans le muscle des récepteurs acétylcholinergiques qui entrainent la contraction
du muscle.
B. Etude de l’effet de l’acétylcholine en présence de prostigmine®
On a maintenant injecté 25 µL de prostigmine à 0,5 M que l’on a laissé incorporer par le
muscle pendant 10 minutes. Ensuite, nous avons refait l’expérience précédente. Cette fois,
nous avons pu noter une forte différence sur l’annexe 1 :
La contraction a été plus forte en présence de prostigmine. En effet, l’amplitude de la
contraction sans prostigmine est de 143,04 mV. En présence de prostigmine, elle est de
489,69 mV. Cette nette augmentation nous permet donc de dire que la prostigmine augmente
l’effet de l’acétylcholine, en effet, c’est un anticholinestérasique qui inhibe la dégradation de
l'acétylcholine par la choline-estérase. Ceci permet à l’acétylcholine de ne pas être dégradée,
et donc de rester dans le milieu pour agir plus longtemps.
C. Etude de l’effet du triéthiodure de gallamine
La nouvelle expérience consiste à injecter 25 µL d’une solution de triéthiodure de gallamine à
1 M dans un volume de 50 mL. De la même façon que dans la partie A, nous calculons une
concentration finale à 5.10-4 M. Après avoir laissé le milieu 10 minutes, nous avons de
nouveau injecté 10 µL d’acétylcholine. On considère cependant que la prostigmine est
toujours dans le muscle, et donc que l’acétylcholine a une action favorisée par une élimination
plus lente. Nous obtenons avec l’annexe 2 les résultats suivants :

La contraction a été plus faible en présence de gallamine qu’en absence. On peut donc
conclure que la gallamine empêche l’action de l’acétylcholine. C’est donc que la gallamine
est un antagoniste compétitif de l’acétylcholine, puisque apparemment, il se fixe sur les
mêmes récepteurs et qu’il empêche l’action de l’acétylcholine. Le fait que l’action de
contraction ait diminué vient de là, l’amplitude étant passée de 489,69 mV à 324,89 mV. On
sait que l’acétylcholine se fixe sur les récepteurs muscariniques et nicotiniques. Or la
gallamine est un curarisant, un antagoniste des récepteurs nicotiniques. C’est donc sur ces
récepteurs que la gallamine fait son travail d’antagoniste, en empêchant l’acétylcholine de se
fixer sur les récepteurs nicotiniques.
D. Etude de l’effet de l’atropine
Pour finir, on recommence nos expériences avec de l’atropine plutôt que de la gallamine. On a
cette fois ajouté 50 µL d’une solution de sulfate d’atropine 1 M dans 50 mL de milieu Ringer.
La concentration en atropine est donc (calculé comme précédemment) de 1.10-3 M. Une
nouvelle fois, après avoir laissé ce milieu 10 minutes, nous avons injecté 10 µL
d’acétylcholine. Nous n’avons pas obtenu les résultats attendus (annexe 3), bien que nous
ayons noté une forte baisse. Nous utilisons donc les résultats fournis par le professeur (annexe
4). Les résultats attendus sont les suivants :
On peut alors se rendre compte qu’après l’injection de l’atropine, l’acétylcholine n’a plus
aucun effet, puisque la contraction ne se fait plus du tout. Avec la forte concentration,
l’atropine a bien fonctionné, et on peut conclure que l’atropine a la même action que la
gallamine, elle est un antagoniste de l’acétylcholine. Cependant, la différence vient du fait que
l’atropine est un antagoniste des récepteurs muscariniques. C’est donc sur ces récepteurs que
se fait son action, en empêchant l’acétylcholine de se fixer. L’amplitude a baissé de 525,3 mV
à 230,5 mV.
III. Conclusion
On peut conclure que l’acétylcholine contracte les muscles grâce aux récepteurs nicotiniques,
que la prostigmine favorise cette action alors que la gallamine et l’atropine la défavorisent,
voir même l’inhibent. Cependant, les deux inhibiteurs n’agissent pas sur le même système, les
mêmes récepteurs, et donc n’ont pas les mêmes actions.
Les récepteurs
Récepteur :
Transduction nécessite une étape de couplage du ligand avec le récepteur, nécessite la
production d’un second messager, molécule diffusible qui va être véhiculée au niveau intra
cellulaire pour déclencher un effet biologique. On les appelle second messagers car le premier
est le ligand. En réalité, ce schéma simple est beaucoup plus complexe.
La première possibilité est le fait qu’un même récepteur peut être couplé à 2 systèmes de
couplages différents.
PLC : phospholipase C
PLA2 : Phospholipase A2
AC : Adénylate cyclase
I. Etude des récepteurs de la cellule pigmentaire de poisson
La plupart des poissons téléostéens (qui présentent une arrête centrale) présentent des écailles
sur leur face externes, qui correspondent au prolongement du derme. Ce sont des structures
inertes que l’on pourrait qualifier de plaques cornées, disposées sur les poissons pour les
protéger, et dans certains poissons comme le gardon (Gardonus rutilus), la disposition des
écailles est de type élasmoïde, c'est-à-dire que les écailles sont disposées en rangées qui se
chevauchent, le bord libre d’une écaille recouvre la partie derme de l’écaille suivante. On
constate que sur l’écaille il y a un certain nombre de stries. Par exemple, les stries radiaires
sont disposées en rayons, et les stries concentriques sont disposées en parallèle les unes par
rapport aux autres. Elles apparaissent avec l’âge du poisson. Plus un poisson vieillit, plus les
stries s’accroissent. Au niveau de ces écailles on trouve un certain nombre de cellules
pigmentées, les Chromatophores, de différents types :
Xantophores : cellules pigmentaires de couleur jaune
Erythrophores : cellules pigmentaires de couleur rouge
Guanophores : aspect irisée, prend toutes les couleurs de l’arc en ciel
Mélanophores (mélanocytes) : aspect étoilé, disposés sur les stries radiaires ou sur les
stries concentriques, de couleur noire due à la mélanine, pigment noir
La mélanine est condensée en granules pigmentaires appelés mélanosomes, ce sont des grains
de mélanine. Ces mélanosomes ne sont observables qu’en microscopie électronique. Les
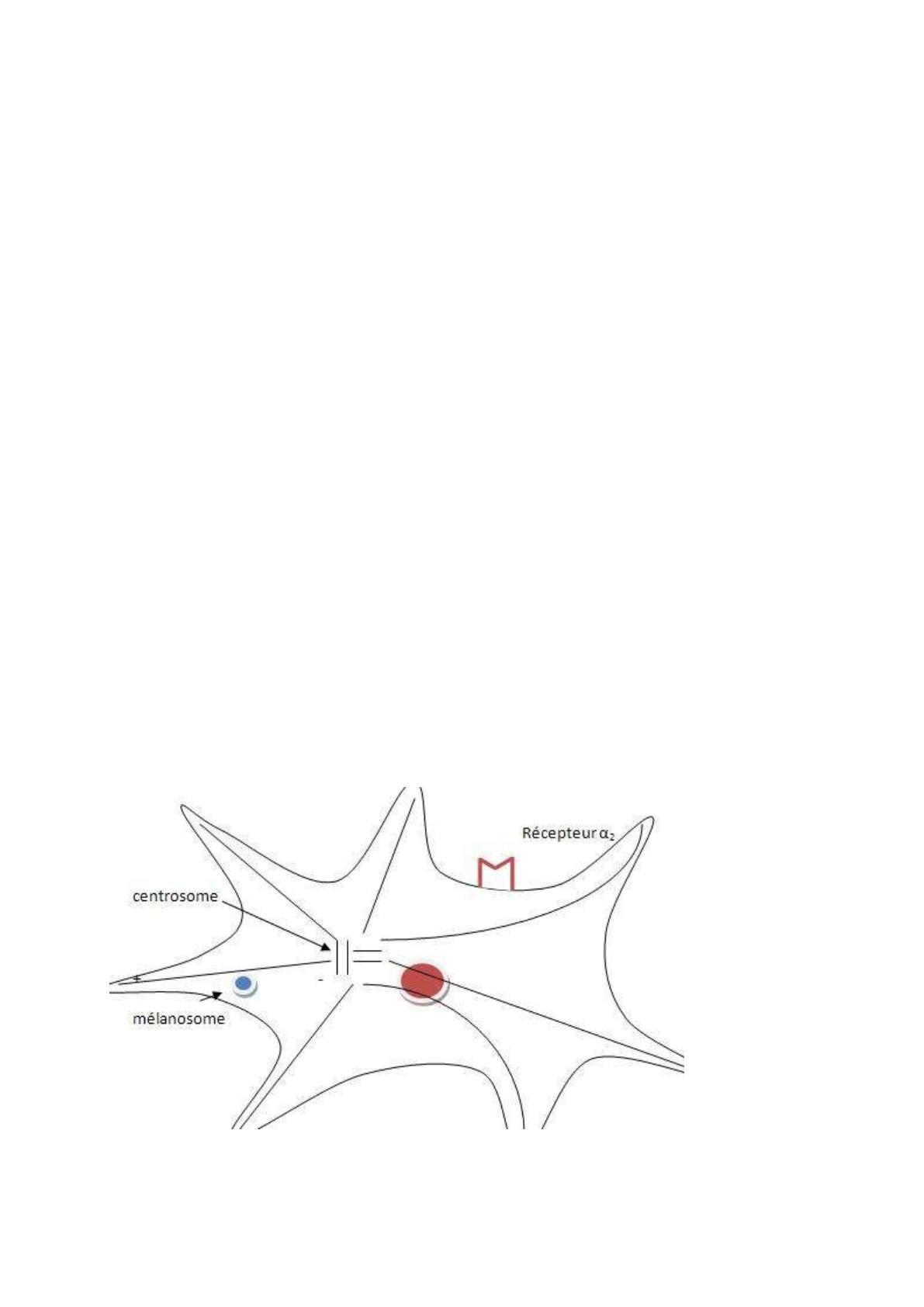
mélanosomes se déplacent sur le cytosquelette, sur un réseau de fibres, appelés microtubules.
Ils prennent naissance dans le centrosome, structure à proximité du noyau.
Extrémité + : lieu de la polymérisation, formation du microtubule
Extrémité - : là où le microtubule se dissocie, à proximité du noyau

Cela n’a rien à voir avec des charges électriques. Le mélanosome se déplace sur le
microtubule, il n’est pas fixé directement dessus, il est relié au réseau de microtubule par des
molécules de liaison appelées molécules de kinésine. Le mélanosome se déplace vers le noyau
ou vers la périphérie, suivant comment se font les ponts de liaison. Ils se font en fonction du
niveau de phosphorylation des kinésines, déterminé par la protéine kinase A, qui va
phosphoryler les kinésines en fonction du taux d’AMPc intracellulaire.
II. La dispersion ou la concentration
Les mélanosomes peuvent se disperser vers la périphérie, alors que la concentration
correspond à un regroupement des mélanosomes vers le centre de la cellule.
A. Cas de l’adrénaline
L’adrénaline est une hormone synthétisée par les glandes surrénales. Ce sont des glandes
situées au dessus des reins. L’adrénaline est libérée en cas de stress. Cette adrénaline est aussi
libérée par les terminaisons nerveuses du système nerveux périphérique, en particulier par la
branche sympathique. Chez le poisson, en cas de stress, l’adrénaline va provoquer dans le
mélanocyte une concentration des cellules pigmentaires, et donc ils se regroupent au centre de
la cellule. On teste les effets de l’adrénaline en présence d’un médicament, le tartrate
d’Ergotamine, qui est une molécule à structure très complexe. C’est une molécule antagoniste
compétitive des récepteurs α2 adrénergiques. Quand on l’applique sur le mélanoside, et que
dans un second temps on applique de l’adrénaline, on constate que le phénomène de
concentration des cellules pigmentaires ne s’observe plus. Le récepteur est couplé à une
protéine Gi (i = inhibitrice). Elle inhibe l’adénylate cyclase, AC. Gi fait le lien entre le
récepteur et l’AC. L’AC transforme l’ATP en AMPc. La concentration en AMPc
intracellulaire diminue, donc il y a moins de PKA, donc un baisse de la phosphorylation des
kinésines, et donc on va avoir une migration des mélanosomes vers le noyau. Ce phénomène
provoque au final un éclaircissement général du poisson, ce qui permet au poisson d’échapper
à ses prédateurs. Il va devenir de plus en plus transparent et se confondre dans
l’environnement.
B. Cas de l’α-MSH
On testera aussi l’α-MSH (α mélanocyte stimulating hormon). Elle est sécrétée par les
systèmes neuro-sécrétoire caudal, système situé au niveau de la queue du poisson. Ca forme
une glande. Chez l’homme, elle est synthétisée au niveau de l’hypophyse postérieure, glande
située à la base du cerveau, elle se trouve juste au dessus du palais. L’α-MSH a un rôle
beaucoup plus important chez les poissons et les amphibiens que chez l’homme, puisqu’elle
contrôle la coloration de la peau de l’animal. On prend par exemple le caméléon. Chez
l’homme, elle intervient pour le bronzage, puisqu’elle entraine la migration des mélanocytes
pour les ramener au niveau de la peau. C’est une hormone qui est un petit peptide de 13 acides
aminé. Quand on applique de l’α-MSH sur les mélanocytes du poisson, les mélanosomes vont
avoir tendance à se répartir en périphérie de la cellule. Il existe des récepteurs à l’α-MSH sur
la cellule. Ces récepteurs sont couplés à la protéine Gs (stimulante) qui active l’adénylate
cyclase, ce qui entraine l’élévation de la concentration intracellulaire en AMPc. Cette AMPc
active la protéine kinase A (PKA), ce qui entraine une phosphorylation des kinésines. D’une
manière générale, l’α-MSH entraine un assombrissement du poisson.
C. Cas de l’acétylcholine
L’acétylcholine est une hormone libérée par le système nerveux, par sa branche
parasympathique. C’est un neurotransmetteur. L’acétylcholine entraine un léger effet de
concentration sur les mélanosomes. Elle agit par l’intermédiaire d’un récepteur M2 à
l’acétylcholine, c’est un récepteur muscarinique, en effet, la muscarine, substance issue de
l’amanite, agit sur ces récepteurs et les active, la muscarine est un agoniste de ces récepteurs.
Ces récepteurs sont couplés à une protéine Gi. Le taux d’AMPc diminue. Les mélanosomes
auront tendance à migrer vers le noyau.
 6
6
 7
7
1
/
7
100%