Electronégativité et nombre d`oxydation
Chimie - 7 ème année - Ecole Européenne
Ecole Européenne de Francfort Page 91
Chapitre n° 6 : ELECTRONEGATIVITE ET NOMBRE D'OXYDATION
I) Réaction d'oxydoréduction par voie sèche
1)
:
Formation de composés ioniques
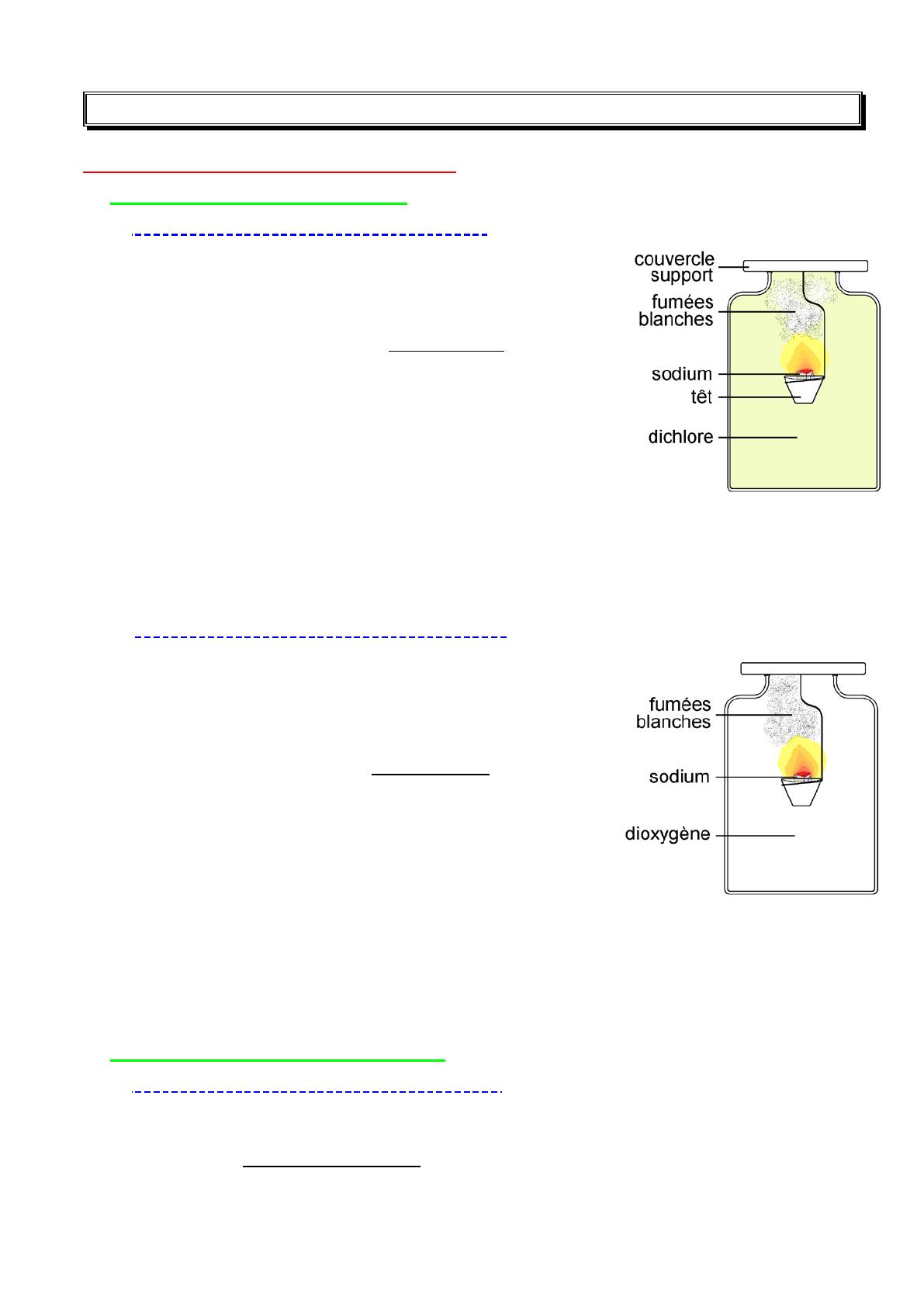
a) Combustion du sodium dans le dichlore :
:
Sous la hotte aspirante, le sodium (Na) enflammé est
introduit dans le bocal de dichlore (Cl2), des fumées
blanches de chlorure de sodium (NaCl) se forment, puis se
déposent sous forme de cristaux blancs (voir figure).
Le chlorure de sodium est un solide ionique
2 Na (s) + Cl2 (g) → 2 NaCl (s)
, formé d'ions
chlorure (Cl−) et d'ions sodium (Na+). Le bilan s'écrit :
Un atome de chlore dans la molécule de dichlore a capté
un électron pour devenir un ion chlorure : le chlore a été
réduit. Simultanément, un atome de sodium dans le métal
a cédé un électron pour devenir un ion sodium : le sodium
a été oxydé. On peut écrire :
d'une part : (Na → Na+ + e−) x 2
d'autre part : Cl2 + 2 e− → 2 Cl−
soit : 2 Na (s) + Cl2 (g) → 2 Na+ + 2 Cl− → 2 NaCl (s)
Cette réaction est une réaction d'oxydoréduction par voie sèche, sans solvant.
b) Combustion du sodium dans le dioxygène :
Le sodium (Na) enflammé est introduit dans le bocal de
dioxygène (O2), il brûle avec une flamme jaune-orange
caractéristique, il se forme des fumées blanches d'oxyde
de sodium (Na2O) sous forme de fine particules solides
(voir figure).
L'oxyde de sodium est un solide ionique
Un atome d'oxygène dans la molécule de dioxygène a
capté un électron pour devenir un ion oxygène : l'oxygène
a été réduit. Simultanément, un atome de sodium dans le
métal a cédé un électron pour devenir un ion sodium : le
sodium a été oxydé.
, formé d'ions
oxygène (O2−) et d'ions sodium (Na+). Le bilan s'écrit :
4 Na (s) + O2 (g) → 2 Na2O (s)
On peut écrire :
d'une part : (Na → Na+ + e−) x 4
d'autre part : O2 + 4 e− → 2 O2−
soit : 4 Na (s) + O2 (g) → 4 Na+ + 2 O2− → 2 Na2O (s)
2) Formation de composés moléculaires
a) Réaction du dihydrogène et du dioxygène :
:
La combustion du dihydrogène et du dioxygène est explosive et produit de l'eau. On a :
2 H2 + O2 → 2 H2O
L'eau est un composé moléculaire
, il est donc difficile de mettre en évidence un transfert
d'électrons entre des espèces.

Electronégativité et nombre d'oxydation
Page 92 Christian BOUVIER
Toutefois, nous avons vu, en 5ème année, que les propriétés électriques de l'eau montrent
que les électrons des doublets formant les deux liaisons covalentes de la molécule sont
plus attirés par l'oxygène que par l'hydrogène.
b) Autres réactions de combustion :
Il existe de nombreux exemples de combustion dans le dioxygène que nous connaissons,
et nous savons qu'il s'agit d'oxydations. Il n'est pas toujours facile de mettre en évidence
un transfert d'électrons.
S + O2 → SO2 (gaz incolore suffocant)
2 S + 3 O2 → 2 SO3 (fumées blanches solides)
N2 + O2 → 2 NO (gaz incolore toxique)
2 NO + O2 → 2 NO2 (fumées rousses suffocantes)
C + O2 → CO2
3) Conclusion
Pour les composés ioniques, il est facile de voir les corps qui s'oxydent et ceux qui se
réduisent, il en va autrement pour les composés moléculaires.
:
Dans tous ces composés moléculaires, il est possible d'affirmer que les liaisons covalentes
entre l'oxygène et les autres atomes sont polarisées. Les électrons sont plus proches
statistiquement
de l'oxygène que du soufre ou du carbone.
II) Electronégativité d'un élément
1)
:
Comparaison du chlore et de l'oxygène
L'expérience montre que le chlorure d'aluminium (AlCl3), dont la température de fusion est
relativement basse, est un
:
composé moléculaire ; au contraire, l'oxyde d'aluminium (Al2O3)
dont on peut produire l'électrolyse ignée (à haute température) est un composé ionique
Nous pouvons donc dire que l'élément oxygène a capté entièrement les électrons de valence
de l'aluminium, dans l'oxyde d'aluminium, alors que le chlore n'a pas la même facilité pour
capter les électrons de valence de l'aluminium :
:
Nous dirons que l'oxygène (O) est plus électronégatif que le chlore (Cl).
2) Comparaison du sodium et de l'aluminium
Le chlorure de sodium (NaCl) est un
:
composé ionique, alors que le chlorure d'aluminium
(AlCl3) est un composé moléculaire
Nous pouvons donc dire que l'élément aluminium n'a pas la même facilité que le sodium
pour céder ses électrons de valence au chlore :
:
Nous dirons que l'aluminium (Al) est plus électronégatif que le sodium (Na).
3) Electronégativité des éléments
Nous pourrions généraliser cette étude comparative qualitative et classer les différents
éléments du tableau périodique par ordre d'électronégativité croissante.
:
L'électronégativité d'un élément est l'aptitude de cet élément à conserver ses électrons de
valence ou à attirer les électrons de valence d'un autre élément lors de sa combinaison avec
d'autres éléments.
Linus Pauling a été le premier chimiste ayant associé un nombre, au caractère électronégatif
des éléments.
Dans une liaison covalente entre deux éléments différents les électrons de liaison sont
statistiquement plus près de l'élément le plus électronégatif : la liaison est polarisée.
Chimie - 7 ème année - Ecole Européenne
Ecole Européenne de Francfort Page 93
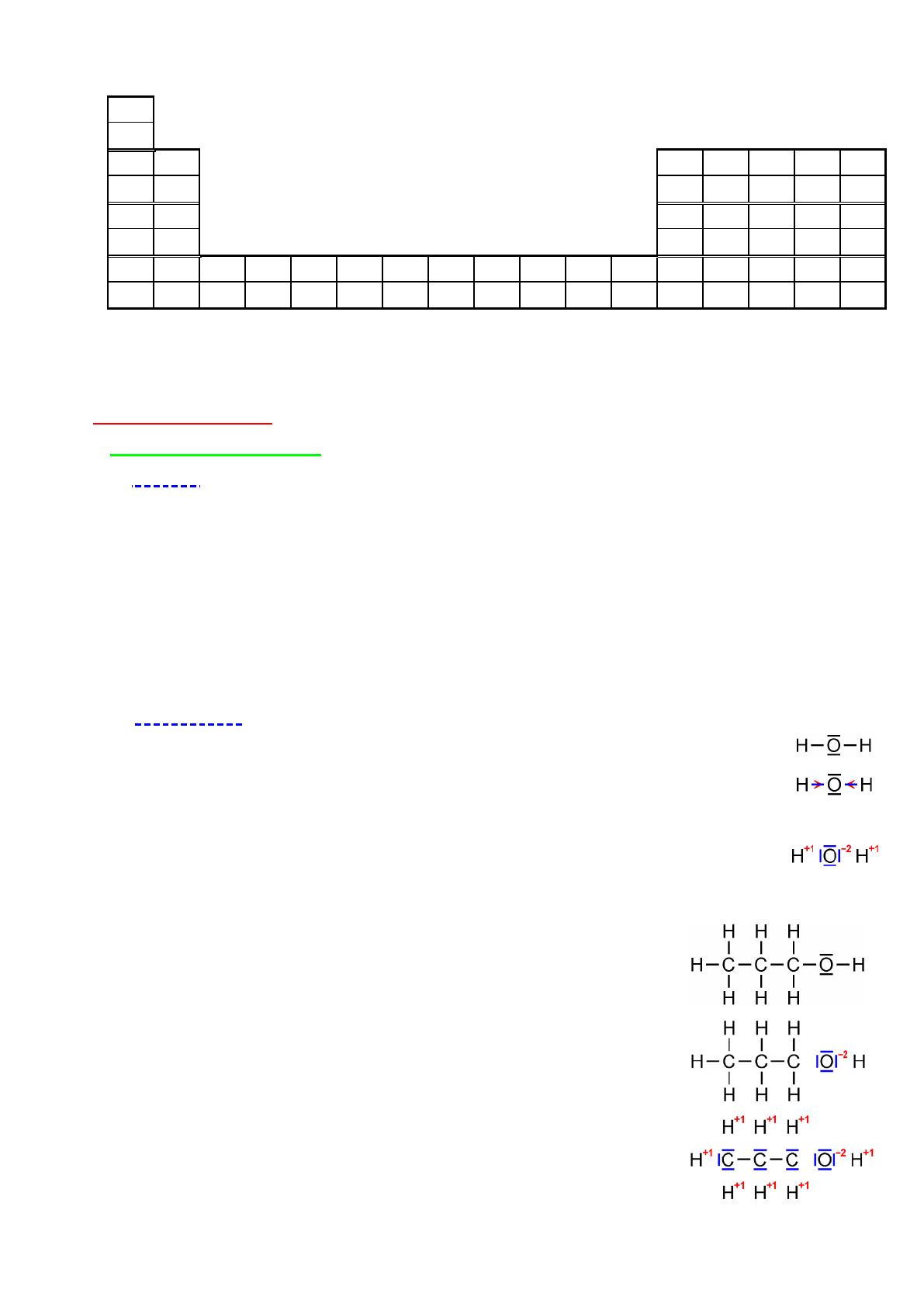
H
Echelle d'électronégativité des premiers éléments
2,2
Li
Be
B
C
N
O
F
1,0
1,6
2,0
2,5
3,0
3,5
4,0
Na
Mg
Al
Si
P
S
Cl
0,9
1,3
1,5
1,7
2,1
2,5
3,1
K
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
0,8 1,0 1,4 1,5 1,6 1,7 1,6 1,8 1,9 1,9 1,9 1,7 1,8 2,0 2,2 2,5 3,0
Nous retiendrons que, en général :
- l'électronégativité d'un élément croît de gauche à droite dans une même ligne,
- l'électronégativité d'un élément diminue de haut en bas dans une même colonne.
III) Nombre d'oxydation
1)
:
Définition de l'I.U.P.A.C.
a) Enoncé :
:
L'I.U.P.A.C. (International Union of Pure and Applied Chemistry), énonce la définition du
nombre d'oxydation (ou degré d'oxydation) d'un atome de la façon suivante :
Le nombre d'oxydation d'un atome X, dans une espèce chimique donnée, est le nombre
de charges qu'aurait cet atome si tous les électrons, de chaque liaison aboutissant à cet
atome, étaient attribués à l'atome le plus électronégatif.
Lorsque les atomes liés sont identiques, les électrons de la (ou des) liaisons sont
équitablement distribués entre ces deux atomes.
On écrit le nombre d'oxydation en chiffre romain.
b) Applications :
- Dans le cas de l'eau : H2O, la représentation de Lewis est :
L'oxygène O étant plus électronégatif que l'hydrogène H, nous attribuons le
doublet électronique liant O à H, entièrement à l'oxygène :
L'atome d'oxygène qui possède 6 e− de valence, se retrouve avec 8 e−, alors
que l'hydrogène qui a 1 e− de valence n'en n'a plus.
Si le transfert du doublet liant été total, nous aurions deux ions :
Nous dirons que, l'hydrogène H a pour nombre d'oxydation +I et l'oxygène O a pour
nombre d'oxydation −II. On a bien, pour la molécule H2O : 2 x (+I) + (−II) = 0
- Cas du propanol : C3H7OH, la représentation de Lewis est :
O étant plus électronégatif que H et C nous attribuons les
doublets électroniques liants, entièrement à l'oxygène :
C étant plus électronégatif que H, nous attribuons les doublets
électroniques liants, entièrement au carbone :

Electronégativité et nombre d'oxydation
Page 94 Christian BOUVIER
Les trois atomes de carbone se partagent équitablement les
doublets liants :
Les atomes d'hydrogène H ont pour nombre d'oxydation +I,
l'oxygène O a pour nombre d'oxydation −II, l'atome de carbone
C, en bout de chaîne, a pour nombre d'oxydation +III, l'atome
de carbone C, du milieu, a pour nombre d'oxydation +II, l'atome
de carbone C fonctionnel, a pour nombre d'oxydation +I,.
On a bien, pour la molécule C3H7OH : 8 x (+I) + (−II) + (−I) + (−II) + (−III) = 0
Dans un corps chimique, les atomes d'un même élément peuvent avoir des nombres
d'oxydation différents.
2) Règles d'application
Dans de nombreux cas (en chimie minérale) nous pourrons nous contenter d'appliquer des
règles simples pour calculer le nombre d'oxydation d'un élément dans un corps chimique.
:
Mais ce ne sont que des règles qui peuvent souffrir parfois d'exceptions.
Pour calculer le nombre d'oxydation nb d'un élément, dans un composé qui contient des
atomes d'hydrogène (H) ou d'oxygène (O), on affecte, en priorité, le nombre d'oxydation
nb = +I à l'élément hydrogène, puis le nombre d'oxydation nb = −II à l'élément oxygène.
Dans un corps simple, quel qu'il soit, le nombre d'oxydation de l'élément est nul.
Exemple : Dans le cas de l'eau : H a pour nombre d'oxydation +I et O a pour nombre
d'oxydation −II. On a bien, pour la molécule H2O : 2 x (+I) + (−II) = 0
Dans le cas de l'ion hydroxyde : H a pour nombre d'oxydation +I et O a pour
nombre d'oxydation −II. On a bien, pour l'ion OH− : (+I) + (−II) = − 1
Remarque : Attention : dans le cas de l'eau oxygénée (peroxyde d'hydrogène H2O2) : H a
pour nombre d'oxydation +I donc O doit avoir pour nombre d'oxydation −I. On a
bien, pour la molécule H2O2 : 2 x (+I) + 2 x (−I) = 0
Exemple : Dans le cas du dihydrogène : H a pour nombre d'oxydation 0. On a bien, pour la
molécule H2 : 2 x (0) = 0
Exemple : Le fer dans l'ion Fe2+ a pour nombre d'oxydation nbFe = +II ; on l'appelle ion fer II.
3) Exemples de calculs du nombre d'oxydation d'un élément
- ammoniac NH3 : on pose pour nbH = +I, pour l'azote : nbN + 3 x nbH = 0,
:
d'où : nbN = − 3 x nbH = − III
- chlorure d'hydrogène HCl : on pose pour nbH = +I, pour le chlore : nbCl + nbH = 0,
d'où : nbCl = − nbH = − I
- Dioxyde de carbone CO2 : on pose pour nbO = −II, pour le carbone : nbC + 2 x nbO = 0,
d'où : nbC = − 2 x nbH = + IV
- ion bichromate Cr2O72− : on pose pour nbO = −II, pour le chrome : 2 x nbCr + 7 x nbO = − 2,
d'où : nbCr = − 7/2 x nbO − 2/2 = + 7 − 1 = + VI
- ion hydrogénocarbonate HCO3− : on pose nbO = −II et nbH = +I : nbH + nbC + 3 x nbO = − 1,
d'où : nbCr = − 3 x nbO − nbH − 1 = + 6 − 1 − 1 = + IV
4) Variation du nombre d'oxydation
- Oxydation : couple Fe3+/Fe2+ :
:
II
Fe2
+
+
→
III
Fe3
+
+
+ e−
Lors de l'oxydation : Le nombre d'oxydation de l'élément fer
augmente : la variation du
nombre d'oxydation est égale au nombre d'électrons cédés.

Chimie - 7 ème année - Ecole Européenne
Ecole Européenne de Francfort Page 95
- Réduction : couple MnO4−/Mn2+ :
VII
MnO
4
+
−
+ 8 H3O+ + 5 e− →
II
Mn2
+
+
+ 12 H2O
Lors de la réduction : Le nombre d'oxydation de l'élément manganèse diminue de 5 unités :
La variation du nombre d'oxydation est égale au nombre d'électrons captés.
Lorsqu'un corps contenant un seul élément est oxydé (réduit), le nombre d'oxydation de cet
élément augmente (diminue).
Lorsqu'un corps composé de plusieurs éléments est oxydé (réduit), le nombre d'oxydation de
l'un de ces éléments augmente (diminue).
IV) Généralisation de l'oxydoréduction
1)
:
Introduction
Dans le chapitre n° 4 "Oxydoréduction en solution aqueuse", § II) 1), nous avons définit
la réaction d'oxydoréduction à partir de l'écriture de deux demi-équations qui traduisent des
échanges complets d'électrons entre oxydant et réducteur. Cette définition ne s'applique pas
à des composés moléculaires lorsqu'ils sont en dehors de solutions aqueuses.
:
Il est impossible d'appliquer cette définition dans un cas aussi connu que la combustion du
carbone dans le dioxygène qui est notoirement une réaction d'oxydation !
C + O2 → CO2
Nous allons donner une définition plus générale de l'oxydoréduction.
2) Rappels
En solution aqueuse nous avons défini le couple d'oxydoréduction : MnO4−/Mn2+, pour lequel
nous pouvons écrire la demi-équation : MnO4− + 8 H3O+ + 5 e− → Mn2+ + 12 H2O
:
Pour généraliser l'oxydoréduction, nous dirons que le manganèse (Mn) a pour nombre
d'oxydation +VII dans le composé MnO4− et le nombre d'oxydation +II dans Mn2+.
Lorsqu'une réaction chimique fait passer du composé ion permanganate (MnO4−) au
composé ion manganèse (Mn2+), l'élément manganèse, dont la variation du nombre
d'oxydation est ∆nb = − 5, subit une réduction.
Bien sûr, conjointement, un autre élément doit subir une oxydation.
Nous ne chercherons pas à séparer par des demi-équations l'oxydation et la réduction.
3) Définitions
Lors d'une oxydoréduction, un élément subit une oxydation, et un autre subit une réduction :
:
- Un élément, dont le nombre d'oxydation augmente (∆nb > 0) au cours d'une réaction
chimique, subit une oxydation.
- Un élément, dont le nombre d'oxydation diminue (∆nb < 0) au cours d'une réaction
chimique, subit une réduction.
Exemple : Considérons la combustion du carbone dans le dioxygène :
Nous faisons apparaître les nombres d'oxydation : 0
C
+ 0
O
2 → IIIV
CO2
−+
Le nombre d'oxydation du carbone varie de ∆nb = + 4, il s'est oxydé, tandis que
celui de l'oxygène ∆nb = − 2, il s'est réduit.
Nous dirons que CO2/C constitue un couple d'oxydoréduction du carbone alors
que O2/CO2 constitue un couple d'oxydoréduction de l'oxygène.
Exemple : Nous pouvons citer les couples :
SO2/S couple du soufre S et O2/CO2 de l'oxygène
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%









